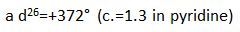Note de l'éditeur: sachant que les révolutions sont faites par plus que de la rhétorique politique, nous imprimons l'article suivant pour tous nos amis chimistes professionnels et amateurs.
(signé: la parution underground qui a relayé cette méthode)
============================================
Bien que seuls quelques amides naturels et synthétiques de l'acide lysergique sont connus, ils possèdent un certain nombre de propriétés pharmacologiques différentes et utiles. Spécialement utile est l'ergonovine, l'amide N-(1 (+) -1-hydroxyisopropyl) de l'acide d-lysergique, qui est utilisé commercialement comme agent ocytocique.
Les tentatives de préparation d'amides d'acide lysergique par les méthodes habituelles de préparation des amides, telles que la réaction d'une amine avec du chlorure d'acide lysergique ou avec un ester d'acide lysergique, ont été infructueuses. Les brevets américains n ° 2 090 429 et n ° 2 090 430. décrivent les processus de préparation des amides de l'acide lysergique et, bien que ces processus sont efficaces pour accomplir la conversion désirée de l'acide lysergique en l'un de ses amides, ils ne sont pas sans certains inconvénients.
Par mon invention, j'ai fourni une méthode simple et commode de préparer des amides d'acide lysergique, qui comprend la réaction de l'acide lysergique avec de l'anhydride trifluoroacétique pour produire un anhydride mélangé d'acides lysergique et trifluoroacétique, et lors de la réaction de l'anhydride mélangé avec une base azotée ayant au moins un hydrogène lié à l'azote. L'amide résultant de l'acide lysergique est isolé du mélange réactionnel par des moyens conventionnels.
La réaction de l'anhydride lysergique et trifluoroacétique est une réaction à basse température, c'est-à-dire, elle doit être effectuée à une température inférieure à environ 0 degrés C. La plage de température est d'environ -15 c. à environ -20 c. Cette fourchette est suffisamment élevée pour permettre à la réaction de se poursuivre à un rythme souhaitable, mais elle fournit néanmoins une protection adéquate contre une réaction trop rapide qui se traduirait par une température de réaction élevée et par conséquent une décomposition excessive du mélange anhydride.
La réaction est effectuée dans un agent de dispersion approprié, c'est-à-dire un agent inerte à l'égard des réactifs. L'acide lysergique est relativement insoluble dans les dispersants aptes à effectuer la réaction, de sorte qu'il est en suspension dans le dispersant.
Deux gallons d'anhydride trifluoroacétique sont requis par mol. d'acide lysergique pour la conversion rapide et complète de l'acide lysergique dans l'anhydride mixte. Il semble qu'une molécule de l'anhydride associe ou favorise un adduit ionique avec une molécule du lysergique qui contient un atome d'azote basique et que c'est l'adduit qui réagit avec une seconde molécule d'anhydride trifluoroacétique pour former le mélange anhydride ainsi qu'une molécule d'acide trifluoroacétique.
La conversion de l'acide lysergique en anhydride mixte se produit dans un laps de temps relativement court, mais pour assurer une conversion complète, la réaction peut prendre environ de une à trois heures.
L'anhydride mixte des acides lysergique et trifluoroacétique est relativement instable, surtout à la température ambiante et au-dessus, et doit être entreposé à basse température. Cette instabilité de l'anhydride mixte par la température rend souhaitable qu'elle soit transformée en un amide d'acide lysergique sans retard inutile. L'anhydride mixte lui-même, puisqu'il contient un groupe d'acide lysergique, peut également exister dans le mélange réactionnel en grande partie en tant qu'adduit ionique avec l'anhydride trifluoroacétique ou l'acide trifluoroacétique. Il est important pour le rendement maximum du produit que l'acide lysergique employé dans la réaction soit sec. Il est le plus commode de sécher l'acide en le chauffant à environ 105-110 degrés C. sous vide d'environ 1 mm. de mercure ou moins pour quelques heures, bien que tout autre moyen usuel de séchage peut être utilisé.
La conversion de l'anhydride mixte en amide par réaction de l'anhydride avec la base azotée, telle qu'un composé aminé, peut être effectuée à la température ambiante ou au-dessous. La réaction s'effectue le plus commodément en ajoutant la solution froide de l'anhydride mélangé au composé aminé ou une solution de celle-ci qui est à la température ambiante.
En raison des composants acides présents dans le mélange réactionnel de l'anhydride mixte, environ cinq mols ou équivalents du composé aminé sont requis par mol ou l'équivalent de l'anhydride mixte pour la conversion maximale de l'anhydride mixte en amide. De préférence un léger excédent par rapport aux cinq mols est utilisé pour assurer l'utilisation complète de l'anhydride mixte. Si vous le souhaitez, une substance basique capable de neutraliser les composants acides présents dans le mélange réactionnel, mais incapable d'interférer avec la réaction, peut être utilisée. Un amine tertiaire fortement basique est un exemple d'une telle substance. Dans ce cas, environ un équivalent de composé aminé à convertir en amide d'acide lysergique, ainsi que tout acide lysergique non converti, peut être retiré du mélange réactionnel et peut-il réutiliser dans d'autres conversions.
La méthode à privilégier pour mener à bien le processus de cette invention est la suivante:
L'acide lysergique sec est mis en suspension dans un véhicule approprié sous forme d'acétonitrile, et la suspension est refroidie à environ-15 c. ou-20 c. À la suspension est ensuite ajoutée lentement une solution d'environ deux équivalents de l'anhydride trifluoroacétique dissout dans de l'acétonitrile et préalablement refroidi à environ-20 degrés C. Le mélange est maintenu à basse température pendant environ une à trois heures pour assurer l'achèvement de la formation de l'anhydride mixte des acides lysergique et trifluoroacétique .
La solution de l'anhydride mixte est ensuite ajoutée à environ cinq équivalents du composé aminé qui doit être mis à réagir avec l'anhydride mixte. Le composé amino n'a pas besoin d'être dissous au préalable dans un solvant, bien qu'il soit généralement pratique d'utiliser un solvant. La réaction est effectuée avec le composé aminé ou la solution de composé aminé à la température ambiante ou au-dessous. Le mélange réactionnel est laissé à température ambiante pendant une ou deux heures, de préférence dans l'obscurité, et le solvant est ensuite enlevé par évaporation sous vide à une température qui n'est de préférence pas supérieure à la température ambiante. Le résidu visqueux, composé de l'amide ainsi que de l'excès d'amine et de sels d'amine, est pris dans un mélange de chloroforme et d'eau. L'eau est séparée et la solution de chloroforme qui contient l'amide est lavée plusieurs fois avec de l'eau pour enlever l'excès d'amine et les divers sels d'amine formés dans la réaction, y compris celui de n'importe quel acide lysergique non converti. La solution de chloroforme est alors séché et évaporé, laissant un résidu d'amide d'acide lysergique. L'amide ainsi obtenu peut être purifié par n'importe quelle procédure conventionnelle.
Les dispersants appropriés aux fins de cette invention sont ceux qui sont des liquides aux températures les plus basses utilisées pour la réaction et sont de nature tellement inerte qu'ils ne réagiront pas à l'acide lysergique avec l'anhydride trifluoroacétique. Parmi les dispersants appropriés on peut citer: acétonitrile, diméthylformamide, propionitrile, etc... D'autres agents appropriés s'ajoutent facilement à l'énumération qui précède. Parmi ceux énumérés ci-dessus, l'acétonitrile est préféré puisqu'il est non réactif et mobile à la température utilisée, et est relativement volatile et donc facilement séparable du mélange réactionnel par évaporation sous vide.
Une grande variété de bases azotées telles que les composés aminés peuvent être réagis avec l'anhydride mélangé pour former un amide d'acide lysergique. Comme indiqué précédemment, le composé aminé doit contenir un atome d'hydrogène attaché à l'azote pour permettre la formation d'amide. Exemples de composés aminés qui peuvent être réagis sont l’ammoniaque, l'hydrazine, les amines primaires comme la glycine, l'éthanolamine, diglycylglycine, noréphédrine, aminopropanol, butanolamine, diéthylamine, éphédrine, et semblables...
Lorsqu'on fait réagir une alcanolamine telle que l'éthanolamine ou l'aminopropanol avec le mélange anhydride des acides lysergique et trifluoroacétique, le produit de réaction contient non seulement l'hydroxy-amide désiré, mais aussi, dans une moindre mesure, certains esters aminés. Ces deux substances isométriques sont dus à la nature bi-fonctionnelle de l'alcanolamine qui réagit. Habituellement, l’ester aminé ne s'élève pas à plus de 25-30 pour cent de la quantité totale de produit de réaction, mais dans les cas où le groupe amino est estériquement entravé, la proportion d'ester aminé sera augmentée. L'ester aminé peut facilement être converti en amide hydroxy désiré, et le rendement sur-tout de ce dernier a augmenté en traitant l'ester aminé, ou le mélange d'amide et d'ester avec l'alcali alcoolique pour causer le réarrangement de l'ester aminé à l'amide hydroxy désiré. Le plus commodément possible, la conversion est effectuée en dissolvant l'ester aminé ou le mélange contenant l'ester aminé dans une quantité minimale d'alcool et en ajoutant au mélange une quantité double de 4 N solution alcoolique d'hydroxyde de potassium. Le mélange est laissé à température ambiante pendant plusieurs heures, l'alcali est neutralisé avec de l'acide, et l'amide acide lysergique est ensuite isolé et purifié.
Il faut comprendre que, tel qu'il est utilisé dans le présent document, le terme «acide lysergique» est utilisé de façon générique comme englobant toute ou la totalité des quatre stéréoisomères possibles ayant la structure de base de l'acide lysergique. Les isomères de la série acide lysergique peuvent être séparés ou interconnectés par des moyens connus de l'art.
Cette invention est illustrée plus en détail par les exemples suivants:
Exemple un
Préparation de l'anhydride mélangé des acides lysergique et trifluoroacétique:
5,36 g. d'acide d-lysergique sont mis en suspension dans 125 ml. d'acétonitrile et la suspension est refroidie à environ-20 degrés C. À cette suspension est ajouté une solution froide (-20 degrés C.) de 8,82 g. d'anhydride trifluoroacétique dans 75 ml d'acétonitrile. Le mélange est autorisé à rester à-20 degrés C. durant environ 1 ½ heures pendant lesquelles le matériau en suspension se dissout, et l'acide d-lysergique est converti en anhydride mixte d'acides lysergique et trifluoroacétique. L'anhydride mixte peut être séparé sous forme d'huile en évaporant le solvant sous vide à une température inférieure à environ 0 degrés centigrade.
Exemple deux
Préparation de l'acide d-lysergique N,N-diéthyl amide :
On obtient une solution d'anhydride mixte d'acide lysergique et d'acide trifluoroacétique par réaction avec 5,36 g. d'acide d-lysergique et 8,82 g. d'anhydride trifluoroacétique dans 200 ml d'acétonitrile selon la procédure de l'exemple un. La solution d'acétonitrile contenant de l'anhydride mixte est ajoutée à 150 ml d'acétonitrile contenant 7,6 g. de diéthylamine. Le mélange est maintenu dans l'obscurité à température ambiante pendant environ deux heures. L'acetonitrile est évaporé in vacuo laissant un résidu qui comprend les formes "normale" et "iso" de l'acide d-lysergique N,N-diéthyle amide avec un peu d'acide lysergique, du sel diéthylamine de l'acide trifluoroacétique et sous-produits similaires. Le résidu est dissout dans un mélange de 150 ml de chloroforme et de 20 ml d'eau glacée. La couche de chloroforme est séparée et la couche aqueuse est extraite avec 4 portions de 50 ml. de chloroforme. Les extraits de chloroforme sont combinés et sont lavés quatre fois avec des parts de 50 ml. d'eau froide afin d'éliminer les quantités résiduelles de sels d'amine. La couche de chloroforme est ensuite séchée au-dessus du sulfate de sodium anhydre, et le chloroforme est évaporé in vacuo. Un résidu solide de 3,45 gm. comprenant les formes "normale" et "iso" de l'acide d-lysergique N,N-diéthylamide est obtenu. Cette matière est dissoute dans 160 ml d'un mélange de 3 à 1 de benzène et de chloroforme et est chromatographié sur 240 g d'alumine de basique. Comme le chromatogramme est développé avec le même solvant, deux zones fluorescentes bleues apparaissent sur la colonne d'alumine.
La zone de déplacement la plus rapide est l'acide d-lysergique N,N-diéthylamide qui est élué avec environ 3000 ml du même solvant que ci-dessus, le cours de l'élution étant suivie en observant le mouvement vers le bas de la zone de fluorescence bleue qui se déplace plus rapidement. L'éluat est traité avec de de l'acide tartrique pour former le tartrate acide de l'acide d-lysergique N,N-diéthyl amide qui est isolé. Le acide tartrate de l'acide d-lysergique N,N-diéthyl amide fond en se décomposant à environ 190-196 degrés centigrades.
L'acide di-iso-lysergique N,N-diéthylamide qui reste absorbé sur la colonne d'alumine comme deuxième zone fluorescente est retiré de la colonne par élution avec le chloroforme. La forme "ISO " de l'amide est récupérée par évaporation de l'éluat de chloroforme jusqu'à la sécheresse .
Exemple trois
Préparation de l'acide d-lysergique N-diéthylaminoéthyl aminoéthyl amide:
On prépare une solution de l'anhydride mixte d'acide lysergique et d'acide trifluoroacétique à partir de 2,68 g d'acide d-lysergique et de 4,4 g d'anhydride d'acide trifluoroacétique dans 100 ml d'acétonitrile par la méthode de l'Example un. Cette solution est ajoutée à 6:03 g. de diéthylamino-éthylamine. Le mélange réactionnel est conservé dans l'obscurité à température ambiante pendant 1 ½ heures. L'acétonitrile est évaporé, et le résidu traité au chloroforme et à l'eau comme décrit dans l'Exemple deux. Le résidu traité comprenant de l'acide d-lysergique N-diéthylaminoéthyl aminoéthyl amide est dissout dans plusieurs ml d'acétate d'éthyle, et la solution est refroidie à environ 0 degré centigrade, après quoi l'acide di-iso-lysergique N-diéthylaminoéthyl aminoéthyl amide se sépare sous forme cristalline. Le matériau cristallin est filtré, et le filtrat réduit en volume pour obtenir une quantité supplémentaire d'amide cristallin. La rRecristallisation à partir d'acétate d'éthyle des fractions combinées de matériau cristallin donne de l'acide d-iso-lysergique N-diéthylaminoéthyl amide fondant à environ 157-158 degrés centigrades.
La rotation optique est la suivante:
Au cours des dernières années, il y a eu beaucoup de discussions au sujet du bon traitement pour les victimes de mauvais voyages au LSD. Quand une personne se trouve dans une panique par l'acide, c'est une situation extrêmement délicate. Bien qu'il ait été dit que les tranquillisants. comme Thorazine, aideront à calmer la personne, il faut être très prudent, car certains médicaments réagissent violemment avec des tranquillisants (STP). Mon Conseil dans une situation de ce genre est juste pour tenter de créer un climat de réconfort et de sympathie. En aucun cas, sauf panique réelle incontrôlable, une personne en acide ne doit être pris à un Hôpital de la ville. Si vous voulez une expérience bizarre, passer quelques heures dans n'importe quel hôpital de la ville pour regarder les gens qui meurent dans les couloirs!
Parlez à la personne et rappelez-lui qu'il est sous l'influence de l'acide. Essayez de le calmer. Même un changement d'environnement peut effectivement renverser un mauvais voyage.